Salud Intestinal, Bienestar y Más: El Papel Esencial de la Serotonina en el Organismo
La serotonina, conocida popularmente como la “hormona de la felicidad“,…
Sigue leyendo


Las enfermedades infecciosas emergentes son frecuentemente causadas por virus respiratorios, que desempeñan papeles importantes en las infecciones del tracto respiratorio, que pueden manifestarse desde un resfriado común hasta enfermedades respiratorias graves (1).
En los últimos 15 años, la detección y secuenciación molecular han posibilitado el aumento de la identificación de los patógenos de enfermedades respiratorias comunes, así como la identificación de patógenos durante pandemias (2).
Las enfermedades respiratorias abarcan una serie de condiciones que afectan el sistema respiratorio, desde la nariz y la garganta hasta los pulmones.
Estas enfermedades pueden ser causadas por diversos factores, incluyendo infecciones virales y bacterianas, exposición a contaminantes ambientales, humo del tabaco y otros irritantes. La gravedad de los síntomas puede variar de leve a grave, pudiendo incluir tos, dificultad para respirar, dolor en el pecho, sibilancias y cansancio extremo.
Según el Foro de Sociedades Respiratorias InteARNcionales, al menos dos mil millones de personas en el mundo están expuestas al humo tóxico proveniente de combustibles de biomasa; y más de dos mil millones inhalan contaminantes y están expuestas al humo del tabaco, resultando en una inmensa carga para la salud mundial, en la cual cinco enfermedades respiratorias se encuentran entre las causas más comunes de muerte en todo el mundo (3):
Varios nuevos virus respiratorios han surgido, incluyendo el virus de la influenza A (también conocido como H1N1), los virus de la gripe aviar A(H7N9) y A(H5N6), el coronavirus responsable del Síndrome Respiratorio del Medio Oriente (MERS), y el nuevo coronavirus (SARS-CoV-2) causante de la pandemia de COVID-19, responsable de más de 14,9 millones de muertes directas e indirectas en todo el mundo, entre el 1 de enero de 2020 y el 31 de diciembre de 2021 (9-12).
Consulta también el artículo “Pruebas de COVID-19: Todo lo que necesitas saber”.
Los virus respiratorios son patógenos que infectan el tracto respiratorio humano, causando una variedad de enfermedades que van desde el resfriado común hasta condiciones más graves como la neumonía y el Síndrome Respiratorio Agudo Severo (SARS).
Estos virus se diseminan principalmente a través de gotas respiratorias expulsadas al toser, estornudar o hablar, y pueden ser transmitidos tanto por contacto directo con personas infectadas como por superficies contaminadas.
Los virus más frecuentemente involucrados en las infecciones respiratorias son los rinovirus, el virus sincicial respiratorio (VSR), los coronavirus, los adenovirus, los virus de la parainfluenza y los virus de la influenza (13).
Todos estos virus comparten la capacidad de transmitirse de persona a persona, y su transmisibilidad está influenciada por el entorno en el que se encuentran el patógeno y el huésped.
Entiende los virus relacionados con las infecciones del tracto respiratorio y los cuadros clínicos asociados:
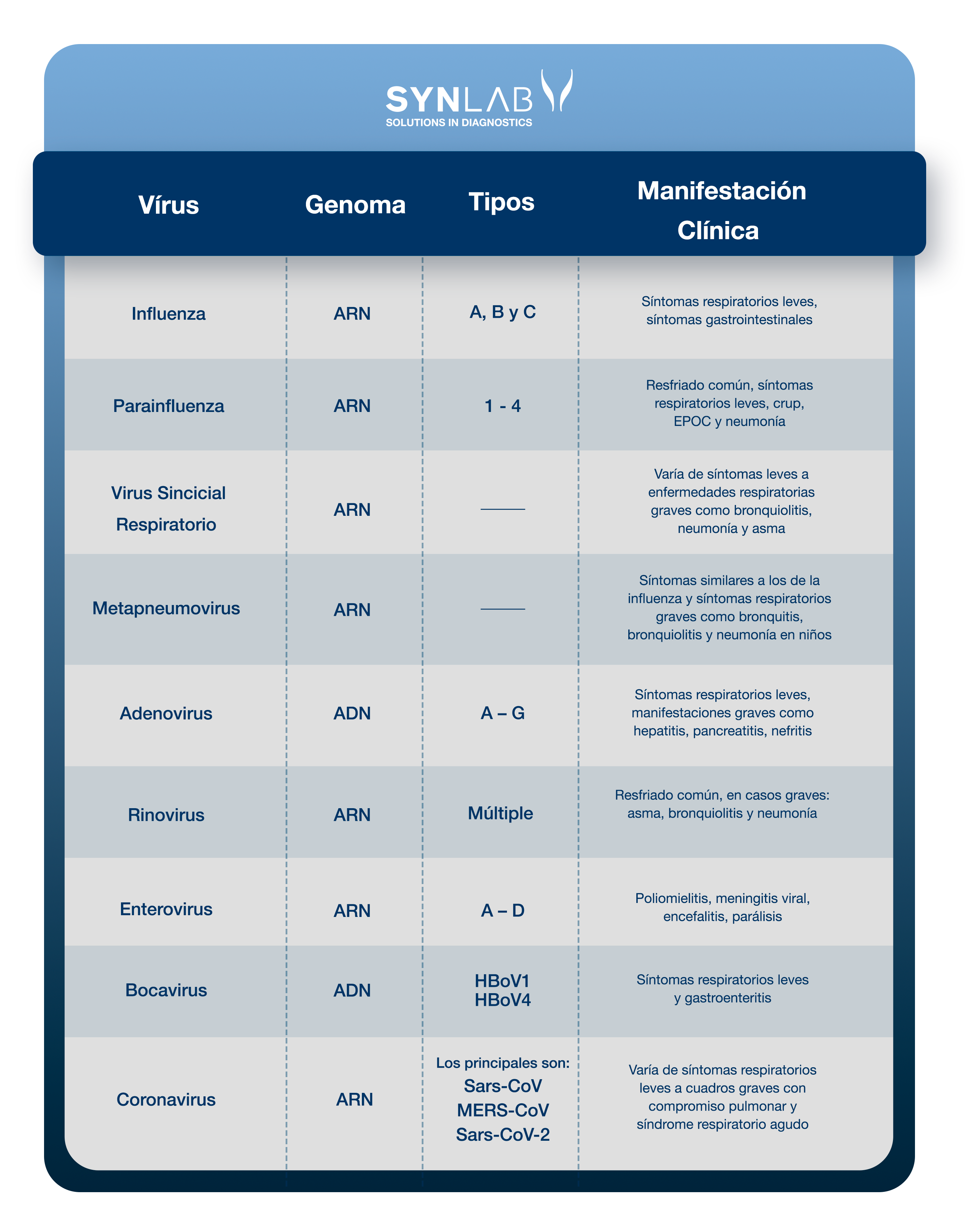
Lee los detalles sobre cada uno de ellos. Si prefieres, haz clic en el nombre para ir a la sección relacionada con el virus:
La influenza es una infección respiratoria causada por el virus de la influenza (Myxovirus influenzae) con tasas significativas de morbilidad y mortalidad en el mundo. Los virus de la influenza se clasifican en tipos A, B y C, a través de sus nucleoproteínas y proteínas de matriz (14).
La influenza o gripe suele causar problemas respiratorios leves como:
Los síntomas pueden persistir de dos a ocho días.
Síntomas gastrointestinales como vómitos y diarrea pueden ocurrir en niños. Una minoría de pacientes, especialmente los ancianos, experimentará enfermedad grave debido a neumonía viral o bacteriana (15).
El virus de la influenza tipo A y B son responsables de epidemias estacionales, siendo característico de la infección por el virus influenza A (H1N1pdm09 y H3N2) el inicio abrupto de:
El subtipo H1N1 emergió de una combinación cuádruple de dos virus porcinos, un virus aviar y un virus humano, causando la pandemia del virus en 2009 (16). Los síntomas suelen ser leves, con cuadros de náuseas, vómitos y diarrea, pero pueden agravarse provocando neumonía o insuficiencia respiratoria.
La incidencia y mortalidad de la gripe porcina o infección por H1N1 es más alta entre los adultos jóvenes y más baja en los pacientes ancianos en comparación con la gripe estacional, muy probablemente porque los más jóvenes no han estado expuestos previamente a otros virus de la influenza similares.
El nombre del virus fue estandarizado a influenza A (H1N1)pdm09 con el fin de denotar la pandemia y distinguir el virus de las cepas estacionales H1N1 y de la cepa pandémica H1N1.
Desde 2011, se han reportado brotes del subtipo H3N2 de origen porcino predominantemente en niños. Además, el virus de la influenza o gripe aviar H5N1 se ha convertido en una preocupación global (17).
Como forma de prevención contra los virus de la influenza, se recomienda la vacunación anual contra la gripe para todas las personas. Los esfuerzos de vacunación deben tener como objetivo principal a las personas con mayor riesgo de influenza complicada o grave (ancianos e inmunosuprimidos) y aquellos que cuidan o viven con individuos de alto riesgo, incluidos los profesionales de salud. Las vacunas actuales contra la gripe estacional también son efectivas contra el virus A (H1N1)pdm09.
El virus parainfluenza (PIV) es un virus de ARN de la familia Paramyxoviridae, clasificado en cuatro serotipos (PIV-1, PIV-2, PIV-3 y PIV-4), que causa diversas enfermedades respiratorias que varían desde resfriado común hasta una síndrome similar a la influenza o neumonía. Es una causa conocida de infección en pacientes pediátricos e inmunocomprometidos, y recientemente está siendo reconocido como un patógeno relevante en adultos hospitalizados, con tasas de infección entre el 2% y el 11% (18).
Es la segunda causa más común de infección del tracto respiratorio inferior en niños.
Los síntomas incluyen:
Hay evidencias que sugieren que el PIV puede resultar en infecciones recurrentes y asintomáticas leves en las poblaciones adultas, con largos períodos de eliminación viral asintomática (> 8 meses) (19,20).
Los serotipos 1 y 2 tienden a provocar epidemias en otoño, con cada serotipo ocurriendo en años alternos. El serotipo 3 suele ser endémico e infecta a la mayoría de los niños menores de un año de edad y puede causar neumonía y bronquiolitis; mientras que el serotipo 4 tiene reactividad cruzada antigénica con el virus de las paperas.
El virus sincicial respiratorio (RSV) es un pneumovirus de ARN envuelto que pertenece a la familia Paramyxoviridae. Es el agente viral más importante que causa enfermedades respiratorias graves en bebés y niños en todo el mundo (21).
Las infecciones por RSV son responsables de un tercio de las muertes relacionadas con infecciones respiratorias agudas en bebés menores de un año de edad y son particularmente problemáticas en bebés prematuros, así como en niños con problemas cardíacos y respiratorios. El virus también causa enfermedad grave en ancianos.
Alrededor del 40 al 60% de los niños son infectados por RSV en el primer año de vida y más del 95% de los niños, a los 2 años de edad, han tenido o tendrán al menos una infección por RSV (22).
Además, la infección por RSV es una causa importante de morbilidad en adultos, particularmente en ancianos e inmunocomprometidos (23).
El RSV se transmite por contacto con las secreciones orales o nasales de la persona infectada cuando tose, estornuda o habla y, de manera indirecta, a través del contacto con superficies y objetos contaminados, causando infecciones recurrentes a lo largo de la vida. Una infección por RSV provoca respuestas inmunitarias innatas y adaptativas; sin embargo, la inmunidad contra el virus no es de larga duración. El período de transmisión comienza dos días antes de que aparezcan los síntomas y solo termina cuando la infección está controlada.
El virus sincicial respiratorio tiene circulación estacional, con una mayor tasa de detección a finales del otoño y principios de la primavera. En regiones tropicales, puede detectarse durante todo el año.
Los principales síntomas asociados pueden variar desde síntomas leves (en personas con buena salud) como:
Hasta condiciones más graves como la bronquiolitis aguda (inflamación de los bronquiolos) y neumonía (25).
El compromiso de las vías respiratorias inferiores ocurre en alrededor del 15–50% de los bebés y niños con infección primaria, y la hospitalización es necesaria en el 1–3% de los casos en bebés de entre 2 y 6 meses de edad, que están en mayor riesgo.
La fase aguda de esta infección a menudo es seguida por episodios de sibilancias que se repiten durante meses o años y generalmente conducen a un diagnóstico de asma.
El tratamiento consiste en broncodilatadores y agentes mucolíticos, mientras que los pacientes pediátricos jóvenes de alto riesgo también reciben tratamiento profiláctico con anticuerpos monoclonales (Palivizumab) (26).
El metapneumovirus humano (HMPV) es una causa significativa de enfermedades del tracto respiratorio superior e inferior en niños y adultos. Se trata de un virus de ARN miembro de la familia Paramyxoviridae, que también incluye el virus sincicial respiratorio (RSV) y los virus parainfluenza (27)
El metapneumovirus generalmente causa infecciones del tracto respiratorio superior y enfermedades similares a la gripe, pero también está asociado con infecciones del tracto respiratorio inferior como: bronquitis sibilante, bronquitis, bronquiolitis y neumonía, en niños muy pequeños, ancianos y pacientes inmunocomprometidos (28, 29).
Los síntomas generalmente incluyen:
En bebés menores de seis meses, el primer síntoma puede ser un período de interrupción de la respiración. Algunos bebés pequeños desarrollan malestar respiratorio grave. En adultos sanos y niños mayores, la enfermedad es normalmente leve y puede manifestarse solo como un resfriado común. La mayoría de los niños no necesitan ser hospitalizados (30).
Cuando es necesario, se analizan muestras de secreciones nasales con una prueba rápida de antígenos, y la técnica de reacción en cadena de la polimerasa (PCR) ayuda a identificar el virus.
La transmisión ocurre por contacto directo con la persona infectada o a través de secreciones infectadas.
El tratamiento en casa consiste principalmente en alivio sintomático.
Estudios de seroprevalencia muestran que la infección primaria ocurre antes de los 5 años de edad y las personas se reinfectan a lo largo de la vida; los cuatro subgrupos de HMPV ocurren con variabilidad año a año (31).
La inmunidad humoral juega un papel importante en la infección por HMPV, y el estudio de anticuerpos HMPV proporciona información valiosa, incluyendo la seroprevalencia de HMPV, protección serológica cruzada entre subgrupos de HMPV y estrategias para profilaxis y terapia utilizando anticuerpos monoclonales (mAbs) (32).
Los anticuerpos monoclonales ampliamente neutralizantes tienen implicaciones clínicas significativas para la profilaxis y el tratamiento de pacientes de alto riesgo.
Los adenovirus (AdVs) son virus de ADN que generalmente causan infecciones leves que afectan el tracto respiratorio superior o inferior y el tracto gastrointestinal. Las infecciones por adenovirus son más comunes en niños pequeños, debido a la falta de inmunidad humoral (33).
Existen siete especies de adenovirus humanos (A – G) y aproximadamente 57 serotipos diferentes. Los predominantes detectados en asociación con enfermedades varían entre países o regiones y pueden cambiar con el tiempo (34).
Los síntomas típicos incluyen:
Los síntomas gastrointestinales pueden estar presentes, particularmente en niños, y la neumonía ocurre en hasta el 20% de los recién nacidos y bebés (35).
El cuadro clínico grave es más probable en pacientes inmunodeprimidos (trasplantados, infección por el virus de inmunodeficiencia humana) y se desarrolla en el 10 al 30% de los casos (36).
Las infecciones por adenovirus están siendo cada vez más reconocidas como causas de enfermedades respiratorias graves y pueden resultar de la exposición a individuos infectados (inalación de gotículas, inoculación conjuntival) y objetos contaminados.
El período de incubación varía de dos a 14 días, y el AdV latente puede residir en tejido linfoide, parénquima renal u otros tejidos durante años; la reactivación puede ocurrir en pacientes gravemente inmunosuprimidos (37).
Los rinovirus humanos (RVs) son responsables de más de la mitad de las enfermedades similares al resfriado, siendo la causa más común de infección del tracto respiratorio superior y costando miles de millones de dólares anualmente en consultas médicas y días perdidos de trabajo y escuela (38).
Aproximadamente el 50% de todos los resfriados son causados por uno de los más de 100 serotipos existentes de rinovirus, que son muy comunes durante el otoño y la primavera y menos comunes durante los meses de invierno.
Los síntomas más comunes son (39):
Los rinovirus se transmiten de persona a persona a través del contacto directo por grandes partículas en el aire. La infección por HRV comienza por inoculación intranasal y conjuntival, pero no por vía oral. Los estudios científicos han demostrado que el virus se deposita regularmente en las manos y se introduce en el entorno, ya que se ha detectado en el 40% de las manos de voluntarios infectados de manera natural y en el 6% de los objetos en el hogar (40).
Los enterovirus respiratorios (EVs), al igual que los rinovirus (RVs), son pequeños virus de ARN y son las principales causas de infecciones del tracto respiratorio superior, estando entre los agentes infecciosos más frecuentes en humanos en todo el mundo (41).
Ambos pertenecen a la familia PicoARNviridae y se han clasificado en siete especies distintas, siendo tres especies de rinovirus (RV-A a RV-C) y cuatro especies de enterovirus (EV-A a EV-D).
A pesar de ser de la misma familia, las características de estos virus son distintas; el tropismo (capacidad de un virus para infectar específicamente ciertas células de un organismo) de los RVs está restringido a las vías respiratorias superiores, excepto en algunos casos raros, mientras que los EVs pueden infectar una amplia gama de células diferentes y causar condiciones clínicas muy diversas (42,43).
Las enfermedades causadas por EVs varían desde:
Mientras que otros tipos de enterovirus se encuentran principalmente en el tracto respiratorio y causan síntomas similares a los del rinovirus, principalmente los EVs de las especies C y D, denominados enterovirus respiratorios.
La transmisión del virus ocurre principalmente por contacto directo o a través de un objeto contaminado (fómites), normalmente con inoculación en el ojo o la nariz mediante la punta del dedo. Estos virus son capaces de sobrevivir en las manos durante varias horas, lo que permite una fácil transmisión de persona a persona en ausencia de una adecuada higiene de manos, especialmente en presencia de altas cargas virales (44).
El bocavirus humano (HBoV) es un parvovirus, aislado hace aproximadamente una década, encontrado en muestras respiratorias, principalmente en niños de 6 a 24 meses de edad con infección respiratoria aguda, y en muestras de heces de pacientes con gastroenteritis (45). Desde entonces, se han identificado tres subtipos adicionales de HBoV (HBoV1) en muestras de heces y se han nombrado como HBoV2, HBoV3 y HBoV4. El virus ha sido detectado en otras muestras biológicas, como sangre, saliva y orina, así como en muestras de agua de río y aguas residuales (46).
El HBoV afecta principalmente a niños de 6 a 24 meses con síntomas respiratorios como:
El HBoV2, al igual que los otros subtipos, se encuentra más frecuentemente en muestras de heces y está asociado con gastroenteritis, así como posiblemente el HBoV3. Estudios más recientes muestran que el HBoV puede ser detectado específicamente en tejidos como el duodeno, la mucosa de los senos paranasales y biopsias intestinales (47,48).
El bocavirus entra en el organismo a través del tracto respiratorio y por la corriente sanguínea o por ingestión directa, alcanzando el tracto gastrointestinal. Los casos de infección por HBoV muestran una alta tasa de coinfecciones con otros patógenos respiratorios y gastroenteritis como rinovirus humano, adenovirus, norovirus y rotavirus (49).
Los coronavirus son una familia de virus de ARN envuelto, clasificados en el orden Nidovirales. Esta familia de coronavirus incluye patógenos de diversas especies animales y humanas, como el coronavirus de la síndrome respiratoria aguda severa (SARS-CoV) y el nuevo coronavirus (SARS-CoV-2) (50).
Los coronavirus humanos eran conocidos únicamente por causar el resfriado común, hasta que, en 2003, el coronavirus SARS-CoV fue responsable del síndrome respiratorio agudo severo (SARS).
Los coronavirus causan enfermedades respiratorias agudas y crónicas, enfermedades entéricas y del sistema nervioso central (SNC) en animales y humanos (51). Los tipos más comunes que infectan a los humanos son:
La infección por SARS presenta un amplio cuadro clínico, caracterizado principalmente por fiebre, disnea, linfopenia e infección del tracto respiratorio inferior (55). Los síntomas gastrointestinales y la diarrea también son comunes. Los individuos infectados muestran conteos de plaquetas ligeramente disminuidos, perfiles de coagulación prolongados y enzimas hepáticas séricas ligeramente elevadas. Se sugiere que las gotas transportadas por el aire de pacientes infectados pueden ser la principal vía de transmisión.
El descubrimiento de la enzima ACE2 en las células humanas como receptor para el SARS-CoV (187) demostró cómo el SARS-CoV entra en las células huésped y ha permitido la elucidación, a nivel molecular, de la transmisión cruzada del SARS-CoV (56).
Obtén más información sobre el SARS-CoV-2 en nuestro artículo.
La prevención de los virus respiratorios está directamente asociada con los cuidados básicos de higiene, tales como:
Evitar aglomeraciones en lugares cerrados y mantener distancia de las personas que presentan signos de enfermedad son medidas importantes para controlar la propagación de los virus.
El diagnóstico de las infecciones respiratorias suele ser clínico, basado en la manifestación de síntomas como resfriado común, bronquiolitis, crup o neumonía, por ejemplo, y en la epidemiología local.
No entanto, los avances en métodos moleculares han facilitado la detección y caracterización de grupos y cepas de los diversos virus respiratorios, y son necesarios principalmente cuando la especificación del patógeno modifica el tratamiento clínico y para identificar y determinar la causa de un brote.
Synlab ofrece un panel molecular de virus respiratorios de ADN y ARN responsables de enfermedades respiratorias, que comprende la detección de los siguientes virus: Influenza A (H1, H3, H1pdm09), Influenza B, Virus Sincicial Respiratorio (A/B), Metapneumovirus, Adenovirus (AdV A/B/C/D/E/F), Coronavirus /CoV 229E/NL63/OC43), Enterovirus, Rinovirus (HRV A/B/C), Bocavirus (HBoV 1/2/3/4), Virus de la Parainfluenza (PIV 1/2/3/4) en muestras del tracto respiratorio superior (exudado nasofaríngeo/orofaríngeo) y muestras del tracto respiratorio inferior (LBA, esputo y/o BAS) obtenidas por hisopo o raspado del sitio afectado.
La detección se realiza mediante reacción en cadena de polimerasa en tiempo real (qPCR).
La realización de exámenes precisos y actualizados es esencial para un diagnóstico más certero y para la mejor orientación de los tratamientos. Y en SYNLAB estamos aquí para ayudarte.
Ofrecemos soluciones diagnósticas con un riguroso control de calidad a empresas, pacientes y médicos que atendemos. Estamos en Brasil desde hace más de 10 años, operamos en 36 países y tres continentes, y somos líderes en la prestación de servicios en Europa.
Ponte en contacto con el equipo de SYNLAB y conoce los exámenes disponibles.
1. Jain S, Self WH, Wunderink RG, et al. Community-Acquired Pneumonia Requiring Hospitalization among U.S. Adults. N Engl J Med. 2015;373(5):415-427.
2. Schuster JE, Williams JV. Emerging Respiratory Viruses in Children. Infect Dis Clin North Am. 2018;32(1):65-74.
3. GBD 2015 Mortality and Causes of Death Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015 [published correction appears in Lancet. 2017 Jan 7;389(10064):e1
4. Burney PG, Patel J, Newson R, Minelli C, Naghavi M. Global and regional trends in COPD mortality, 1990-2010. Eur Respir J. 2015;45(5):1239-1247.
5. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87-108.
6. World Health Organization. Global tuberculosis report 2020. Geneva: World Health Organization; 2020.
7. The Global Asthma Report 2018. Auckland, New Zealand: Global Asthma Network, 2018
8. World Health Organization. Influenza (Seasonal). October 2023.
9. Cheng VC, To KK, Tse H, Hung IF, Yuen KY. Two years after pandemic influenza A/2009/H1N1: what have we learned?. Clin Microbiol Rev. 2012;25(2):223-263.
10. To KK, Chan JF, Chen H, Li L, Yuen KY. The emergence of influenza A H7N9 in human beings 16 years after influenza A H5N1: a tale of two cities. Lancet Infect Dis. 2013;13(9):809-821.
11. Chan JF, Lau SK, To KK, Cheng VC, Woo PC, Yuen KY. Middle East respiratory syndrome coronavirus: another zoonotic betacoronavirus causing SARS-like disease. Clin Microbiol Rev. 2015;28(2):465-522.
12. World Health Organization. 14.9 million excess deaths associated with the COVID-19 pandemic in 2020 and 2021 [Internet]. 5 May 2022.
13. DOLIN R. Common viral respiratory infections and severe acute respiratory syndrome (SARS). In: FAUCI, A.S. et al.. Harrison’s Principles of Internal Medicine. 17 ed.. Philadelphia: MacGraw-Hill, 2007.
14. Gaitonde DY, Moore FC, Morgan MK. Influenza: Diagnosis and Treatment. Am Fam Physician. 2019;100(12):751-758.
15. Centers for Disease Control and Prevention. Clinical Signs and Symptoms of Influenza. 2022
16. Dawood FS, Iuliano AD, Reed C, et al. Estimated global mortality associated with the first 12 months of 2009 pandemic influenza A H1N1 virus circulation: a modelling study [published correction appears in Lancet Infect Dis. 2012 Sep;12(9):655]. Lancet Infect Dis. 2012;12(9):687-695.
17. Duwell MM, Blythe D, Radebaugh MW, et al. Influenza A(H3N2) Variant Virus Outbreak at Three Fairs – Maryland, 2017. MMWR Morb Mortal Wkly Rep. 2018;67(42):1169-1173. Published 2018 Oct 26.
18. Henrickson KJ. Parainfluenza viruses. Clin Microbiol Rev. 2003;16(2):242-264. doi:10.1128/CMR.16.2.242-264.2003
19. Hutchinson AF, Ghimire AK, Thompson MA, et al. A community-based, time-matched, case-control study of respiratory viruses and exacerbations of COPD. Respir Med. 2007;101(12):2472-2481.
20. Peck AJ, Englund JA, Kuypers J, et al. Respiratory virus infection among hematopoietic cell transplant recipients: evidence for asymptomatic parainfluenza virus infection. Blood. 2007;110(5):1681-1688.
21. Lozano R, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. The Lancet. 2012; Volume 380: 2095-2128.
22. Instituto Fernandes Figueira – Fiocruz. Prevenção de infecção pelo vírus sincicial respiratório (VSR) em unidades neonatais e na comunidade. 2019
23. Rezaee F, Linfield DT, Harford TJ, Piedimonte G. Ongoing developments in RSV prophylaxis: a clinician’s analysis. Curr Opin Virol. 2017;24:70-78.
24. Bloom-Feshbach K, Alonso WJ, Charu V, Tamerius J, Simonsen L, et al. (2013) Latitudinal Variations in Seasonal Activity of Influenza and Respiratory Syncytial Virus (RSV): A Global Comparative Review. PLOS ONE 8(2): e54445.
25. Houben ML, Bont L, Wilbrink B, et al. Clinical prediction rule for RSV bronchiolitis in healthy newborns: prognostic birth cohort study. Pediatrics. 2011;127(1):35-41.
26. American Academy of Pediatrics Committee on Infectious Diseases; American Academy of Pediatrics Bronchiolitis Guidelines Committee. Updated guidance for palivizumab prophylaxis among infants and young children at increased risk of hospitalization for respiratory syncytial virus infection. Pediatrics. 2014;134(2):e620-e638.
27. van den Hoogen BG, de Jong JC, Groen J, et al. A newly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med. 2001;7(6):719-724.
28. Stockton J, Stephenson I, Fleming D, Zambon M. Human metapneumovirus as a cause of community-acquired respiratory illness. Emerg Infect Dis. 2002;8(9):897-901.
29. Pelletier G, Déry P, Abed Y, Boivin G. Respiratory tract reinfections by the new human Metapneumovirus in an immunocompromised child. Emerg Infect Dis. 2002;8(9):976-978.
30. Ebihara T, Endo R, Kikuta H, Ishiguro N, Ishiko H, Hara M, Takahashi Y, Kobayashi K. Human metapneumovirus infection in Japanese children. J Clin Microbiol. 2004 Jan;42(1):126-32.
31. Ebihara T, Endo R, Kikuta H, et al. Human metapneumovirus infection in Japanese children. J Clin Microbiol. 2004;42(1):126-132.
32. Schuster JE, Williams JV. Human Metapneumovirus. Microbiol Spectr. 2014;2(5):10.1128/microbiolspec.AID-0020-2014.
33. Lynch JP 3rd, Kajon AE. Adenovirus: Epidemiology, Global Spread of Novel Serotypes, and Advances in Treatment and Prevention. Semin Respir Crit Care Med. 2016;37(4):586-602.
34. Erdman DD, Xu W, Gerber SI, et al. Molecular epidemiology of adenovirus type 7 in the United States, 1966-2000. Emerg Infect Dis. 2002;8(3):269-277.
35. Chang SY, Lee CN, Lin PH, et al. A community-derived outbreak of adenovirus type 3 in children in Taiwan between 2004 and 2005. J Med Virol. 2008;80(1):102-112.
36. Kim YJ, Boeckh M, Englund JA. Community respiratory virus infections in immunocompromised patients: hematopoietic stem cell and solid organ transplant recipients, and individuals with human immunodeficiency virus infection. Semin Respir Crit Care Med. 2007;28(2):222-242.
37. Ison MG. Adenovirus infections in transplant recipients. Clin Infect Dis. 2006;43(3):331-339.
38. Bertino JS. Cost burden of viral respiratory infections: issues for formulary decision makers. Am J Med. 2002;112 Suppl 6A:42S-49S.
39. Pappas DE, Hendley JO, Hayden FG, Winther B. Symptom profile of common colds in school-aged children. Pediatr Infect Dis J. 2008;27(1):8-11.
40. Gwaltney JM Jr, Moskalski PB, Hendley JO. Hand-to-hand transmission of rhinovirus colds. Ann Intern Med. 1978;88(4):463-467.
41. Royston L, Tapparel C. Rhinoviruses and Respiratory Enteroviruses: Not as Simple as ABC. Viruses. 2016 Jan 11;8(1):16.
42. Tapparel C, Siegrist F, Petty TJ, Kaiser L. Picornavirus and enterovirus diversity with associated human diseases. Infect Genet Evol. 2013;14:282-293.
43. Romero JR, Newland JG. Viral meningitis and encephalitis: traditional and emerging viral agents. Semin Pediatr Infect Dis. 2003;14(2):72-82.
44. L’Huillier AG, Tapparel C, Turin L, Boquete-Suter P, Thomas Y, Kaiser L. Survival of rhinoviruses on human fingers. Clin Microbiol Infect. 2015;21(4):381-385.
45. Allander T, Tammi MT, Eriksson M, Bjerkner A, Tiveljung-Lindell A, Andersson B. Cloning of a human parvovirus by molecular screening of respiratory tract samples [published correction appears in Proc Natl Acad Sci U S A. 2005 Oct 25;102(43):15712]. Proc Natl Acad Sci U S A. 2005;102(36):12891-12896.
46. Kapoor A, Slikas E, Simmonds P, et al. A newly identified bocavirus species in human stool. J Infect Dis. 2009;199(2):196-200.
47. Jartti T, Hedman K, Jartti L, Ruuskanen O, Allander T, Söderlund-Venermo M. Human bocavirus-the first 5 years. Rev Med Virol. 2012;22(1):46-64.
48. Santos N, Peret TC, Humphrey CD, et al. Human bocavirus species 2 and 3 in Brazil. J Clin Virol. 2010;48(2):127-130.
49. Schildgen O. Human bocavirus: lessons learned to date. Pathogens. 2013;2(1):1-12. Published 2013 Jan 11.
50. Weiss SR, Navas-Martin S. Coronavirus pathogenesis and the emerging pathogen severe acute respiratory syndrome coronavirus. Microbiol Mol Biol Rev. 2005 Dec;69(4):635-64.
51. McIntosh, K. (1974). Coronaviruses: A Comparative Review. In: Arber, W., et al. Current Topics in Microbiology and Immunology / Ergebnisse der Mikrobiologie und Immunitätsforschung. Current Topics in Microbiology and Immunology / Ergebnisse der Mikrobiologie und Immunitätsforschung, vol 63. Springer, Berlin, Heidelberg.
52. Ebihara T, Endo R, Ma X, Ishiguro N, Kikuta H. Detection of human coronavirus NL63 in young children with bronchiolitis. J Med Virol. 2005;75(3):463-465.
53. Woo PC, Lau SK, Chu CM, et al. Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia. J Virol. 2005;79(2):884-895.
54. Ksiazek TG, Erdman D, Goldsmith CS, et al. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med. 2003;348(20):1953-1966.
55. Tsui PT, Kwok ML, Yuen H, Lai ST. Severe acute respiratory syndrome: clinical outcome and prognostic correlates. Emerg Infect Dis. 2003;9(9):1064-1069.
56. Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003;426(6965):450-454.
57. Chan JFW, et al. The emerging novel Middle East respiratory syndrome coronavirus: The “knowns” and “unknowns”. Journal of the Formosan Medical Association. 2013; Volume 112: 372-381.
58. Al-Tawfiq JA, Hinedi K, Ghandour J, et al. Middle East respiratory syndrome coronavirus: a case-control study of hospitalized patients. Clin Infect Dis. 2014;59(2):160-165.
La serotonina, conocida popularmente como la “hormona de la felicidad“,…
Sigue leyendo
¿Alguna vez has sentido malestar después de comer ciertos alimentos,…
Sigue leyendo
La dermatomiositis es una enfermedad inflamatoria rara que afecta la…
Sigue leyendo