Saúde intestinal, bem-estar e mais: o papel essencial da serotonina no organismo
A serotonina, conhecida popularmente como o “hormônio da felicidade”, é…
Continuar lendo


As doenças infecciosas emergentes são frequentemente causadas por vírus respiratórios, que desempenham papéis importantes nas infecções do trato respiratório, que podem se manifestar desde um resfriado comum a graves doenças respiratórias (1).
Nos últimos 15 anos, a detecção e o sequenciamento moleculares possibilitaram o aumento da identificação dos patógenos de doenças respiratórias comuns, assim como a identificação de patógenos durante pandemias (2).
As doenças respiratórias abrangem uma série de condições que afetam o sistema respiratório, desde o nariz e garganta até os pulmões.
Essas doenças podem ser causadas por diversos fatores, incluindo infecções virais e bacterianas, exposição a poluentes ambientais, fumaça do tabaco e outros irritantes. A gravidade dos sintomas pode variar de leve a grave, podendo incluir tosse, falta de ar, dor no peito, sibilos e cansaço extremo.
Segundo o fórum das Sociedades Respiratórias Internacionais, pelo menos dois bilhões de pessoas no mundo estão expostas à fumaça tóxica provenientes de combustível de biomassa; e mais de dois bilhões inalam poluentes e estão expostas à fumaça do tabaco, resultando em imensa carga para a saúde mundial, no qual cinco doenças respiratórias estão entre as causas mais comuns de morte em todo o mundo (3):
Vários novos vírus respiratórios surgiram, incluindo o vírus da influenza A (também conhecido como H1N1), os vírus da gripe aviária A(H7N9) e A(H5N6), o coronavírus responsável pela Síndrome respiratória do Oriente Médio (MERS), e o novo coronavírus (Sars-CoV-2) causador da pandemia de COVID-19, responsável por mais de 14,9 milhões de óbitos diretos e indiretos em todo o mundo, entre 1 de janeiro de 2020 e 31 de dezembro de 2021 (9-12).
Confira também o artigo “Testes de COVID-19: Tudo o que você precisa saber”.
Os vírus respiratórios são patógenos que infectam o trato respiratório humano, causando uma variedade de doenças que variam desde o resfriado comum até condições mais graves como a pneumonia e a Síndrome Respiratória Aguda Grave (SARS).
Esses vírus se disseminam principalmente por meio de gotículas respiratórias expelidas ao tossir, espirrar ou falar, e podem ser transmitidos tanto por contato direto com pessoas infectadas quanto por superfícies contaminadas.
Os vírus mais frequentemente envolvidos nas infecções respiratórias são rinovírus, vírus sincicial respiratório (VSR), coronavírus, adenovírus, parainfluenza e influenza (13).
Todos esses vírus compartilham a capacidade de transmitir de pessoa para pessoa, e a sua transmissibilidade é influenciada pelo ambiente em que o patógeno e o hospedeiro se encontram.
Entenda os vírus relacionados com as infecções do trato respiratório e os quadros clínicos associados:
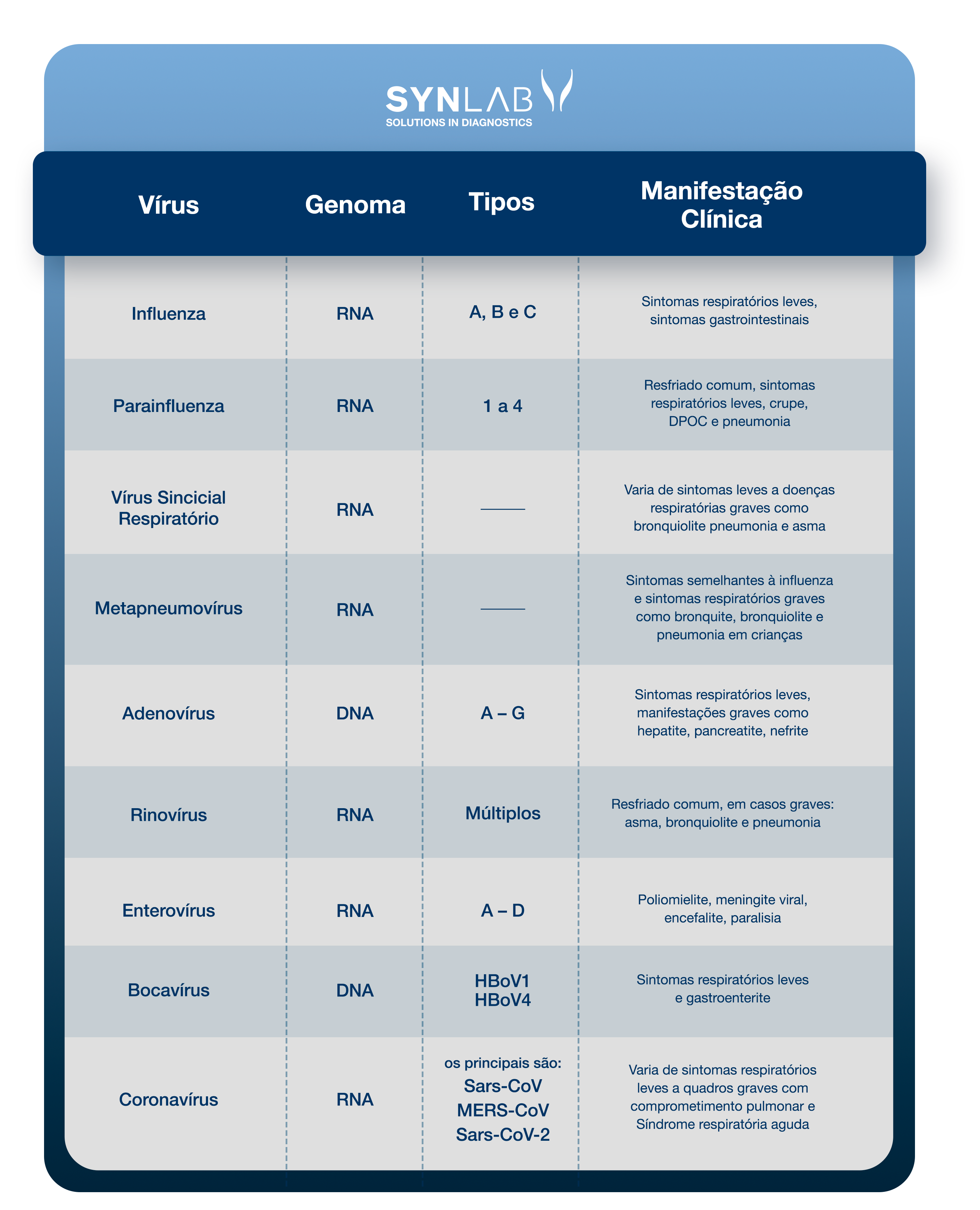
Leia os detalhes sobre cada um deles. Se preferir, clique no nome para ir à sessão relacionada ao vírus:
A influenza é uma infecção respiratória causada pelo vírus influenza (Myxovirus influenzae) com taxas significativas de morbidade e mortalidade no mundo. Os vírus da influenza são classificados como tipo A, B e C, através de suas nucleoproteínas e proteínas matrizes (14).
A influenza ou gripe costuma causar problemas respiratórios leves como:
Os sintomas podem persistir por dois a oito dias.
Sintomas gastrointestinais como vômitos e diarreia podem ocorrer em crianças. Uma minoria de pacientes, especialmente idosos, experimentará doença grave devido a pneumonia viral ou bacteriana (15).
O vírus influenza tipo A e B são responsáveis por epidemias sazonais, sendo característico da infecção pelo vírus influenza A (H1N1pdm09 e H3N2) o início abrupto de:
O subtipo H1N1 emergiu de um agrupamento quádruplo de dois vírus suínos, um vírus aviário e um vírus humano, causando a pandemia pelo vírus em 2009 (16). Nos quais os sintomas costumam ser leves com quadros de náuseas, vômitos e diarreia, mas podem se agravar provocando pneumonia ou insuficiência respiratória.
A incidência e a mortalidade da gripe suína ou infecção pelo H1N1 é mais alta entre adultos jovens e mais baixa nos pacientes idosos do que as de gripe sazonal, muito provavelmente pelo fato de os mais jovens não terem sido expostos previamente a outros vírus da influenza semelhantes.
O nome do vírus foi padronizado para influenza A (H1N1)pdm09 com o intuito de denotar a pandemia e distinguir o vírus das cepas sazonais H1N1 e da cepa H1N1 pandêmica.
Desde 2011, surtos do subtipo H3N2 de origem suína têm sido relatados predominantemente em crianças. Além disso, o vírus da influenza ou gripe aviária H5N1 tornou-se uma preocupação global (17).
Como forma de prevenção aos vírus influenzas, recomenda-se a vacinação anual contra a gripe para todas as pessoas. Os esforços de vacinação devem ter como alvo principalmente as pessoas com maior risco de influenza complicada ou grave (idosos e imunossuprimidos) e aqueles que cuidam ou vivem com indivíduos de alto risco, incluindo profissionais de saúde. As vacinas atuais contra gripe sazonal também são eficazes contra o vírus A (H1N1)pdm09.
O vírus parainfluenza (PIV) é um vírus de RNA da família Paramyxoviridae, classificado em quatro sorotipos (PIV-1, PIV-2, PIV-3 e PIV-4), que causam diversas doenças respiratórias que variam desde resfriado comum a uma síndrome semelhante à influenza ou pneumonia, sendo uma causa conhecida de infecção em pacientes pediátricos e imunocomprometidos, e recentemente está sendo reconhecido como um patógeno relevante em adultos hospitalizados, com taxas de infecção entre 2 e 11% (18).
São a segunda causa mais comum de infecção do trato respiratório inferior em crianças.
Os sintomas incluem:
Há evidências sugerindo que o PIV pode resultar em infecções recorrentes e assintomáticas leves nas populações adultas, com longos períodos de eliminação viral assintomática (> 8 meses) (19,20).
Os sorotipos 1 e 2 tendem a provocar epidemias no outono, com cada sorotipo ocorrendo em anos alternados. O sorotipo 3 costuma ser endêmico e infecta a maioria das crianças com menos de um ano de idade e pode causar pneumonia e bronquiolite; enquanto o sorotipo 4 tem reatividade cruzada antigênica com o vírus da caxumba.
O vírus sincicial respiratório (RSV) é um pneumovírus de RNA envelopado pertencente à família dos Paramyxoviridae. É o mais importante agente viral que causa doenças respiratórias graves em bebês e crianças no mundo todo (21).
As infecções por RSV são responsáveis por um terço das mortes relacionadas à infecção respiratória inferior aguda em bebês com menos de um ano de idade e são particularmente problemáticos em bebês prematuros, bem como em crianças com problemas cardíacos e problemas respiratórios. O vírus também causa doença grave em idosos.
Cerca de 40 a 60% das crianças são infectadas pelo VSR no primeiro ano de vida e mais de 95% das crianças, aos 2 anos de idade teve ou terá pelo menos uma infecção por RSV (22).
Além disso, a infecção por RSV é uma causa importante de morbidade em adultos, particularmente em idosos e imunocomprometidos (23).
O RSV é transmitido por contato com as secreções orais ou nasais da pessoa infectada quando tosse, espirra ou fala e, de forma indireta, pelo contato com superfícies e objetos contaminados e causa infecções de repetição ao longo da vida. Uma infecção por RSV provoca respostas imunes inatas e adaptativas, porém a imunidade contra o vírus não é de longa duração. O período de transmissão começa dois dias antes de aparecerem os sintomas e só termina quando a infecção está controlada.
O vírus sincicial respiratório tem circulação sazonal, com maior taxa de detecção no final do outono e início da primavera. Em regiões tropicais pode ser detectado o ano todo.
Os principais sintomas associados podem variar desde sintomas leves (em pessoas com boas condições de saúde) como:
Até condições mais graves como a bronquiolite aguda (inflamação dos bronquíolos) e pneumonia (25).
O envolvimento das vias aéreas inferiores ocorre em cerca de 15–50% dos bebês e crianças com infecção primária, a hospitalização se faz necessária em 1–3% dos casos com bebês entre 2 e 6 meses de idade, que estão em maior risco.
A fase aguda desta infecção é frequentemente seguida por episódios de chiado que se repetem por meses ou anos e geralmente levam a um diagnóstico de asma.
O tratamento consiste em broncodilatadores e agentes mucolíticos, enquanto pacientes pediátricos jovens de alto risco também recebem tratamento profilático com anticorpos monoclonais (Palivizumab) (26).
Metapneumovírus humano (HMPV) é uma causa significativa de doenças do trato respiratório superior e inferior em crianças e adultos. Trata-se de um vírus de RNA membro da família Paramyxoviridae, que também inclui o vírus sincicial respiratório (RSV) e os vírus parainfluenza (27).
O metapneumovírus geralmente causa infecção do trato respiratório superior e doenças semelhantes à gripe, mas também está associado a infecções do trato respiratório inferior como: bronquite sibilante, bronquite, bronquiolite e pneumonia, em crianças muito pequenas, idosos e pacientes imunocomprometidos (28, 29).
Os sintomas geralmente incluem:
Em bebês com menos de seis meses de idade, o primeiro sintoma pode ser um período de interrupção da respiração. Alguns bebês pequenos desenvolvem desconforto respiratório grave. Em adultos saudáveis e crianças mais velhas, a doença é normalmente leve e pode se manifestar apenas na forma de um resfriado comum. A maioria das crianças não precisa ser internada no hospital (30).
Quando necessário, amostras de secreção nasal são analisadas com um exame rápido de antígenos, e a técnica da reação em cadeia de polimerase (PCR) ajuda a identificar o vírus.
A transmissão ocorre por contato direto com a pessoa infectada ou próximo com secreções infectadas.
O tratamento em casa consiste principalmente de alívio sintomático.
Estudos de soroprevalência demonstram que a infecção primária ocorre antes dos 5 anos de idade e as pessoas são reinfectadas ao longo da vida, os quatro subgrupos de HMPV ocorrem com variabilidade ano a ano (31).
A imunidade humoral desempenha um importante papel na infecção pelo HMPV, e o estudo de anticorpos HMPV fornece informações importantes incluindo a soroprevalência de HMPV, proteção sorológica cruzada entre subgrupos de HMPV e estratégias para profilaxia e terapia usando anticorpos monoclonais (mAbs) (32).
Os anticorpos monoclonais amplamente neutralizantes têm implicações clínicas significativas para profilaxia e tratamento de hospedeiros de alto risco.
Os adenovírus (AdVs) são vírus de DNA que geralmente causam infecções leves envolvendo o trato respiratório superior ou inferior e o trato gastrointestinal. As infecções por adenovírus são mais comuns em crianças pequenas, devido à falta de imunidade humoral (33).
Existem sete espécies de adenovírus humanos (A – G) e aproximadamente 57 diferentes sorotipos e os predominantes detectados em associação com doença diferem entre países ou regiões, e podem sofrer alterações ao longo do tempo (34).
Os sintomas típicos incluem:
Os sintomas gastrointestinais podem estar presentes particularmente em crianças e pneumonia ocorre em até 20% de recém-nascidos e bebês (35).
O quadro clínico grave é mais provável em pacientes imunodeprimidos (transplantados, infecção pelo vírus da imunodeficiência humana) e se desenvolve em 10 a 30% dos casos (36).
As infecções por adenovírus estão sendo cada vez mais reconhecidas como causas de doença respiratória grave e podem resultar da exposição a indivíduos infectados (inalação de gotículas, inoculação conjuntival) e objetos contaminados.
O período de incubação varia de dois a 14 dias, e o AdV latente pode residir em tecido linfóide, parênquima renal ou outros tecidos por anos; a reativação pode ocorrer em pacientes gravemente imunossuprimidos (37).
Os rinovírus humanos (RVs), são responsáveis por mais da metade das doenças semelhantes ao resfriado, sendo a causa mais comum de infecção do trato respiratório superior e custam bilhões de dólares anualmente em consultas médicas e dias perdidos de trabalho e escola (38).
Aproximadamente 50% de todos os resfriados são causados por um dos mais de 100 sorotipos existentes do rinovírus, que são muito comuns durante outono e primavera e menos comuns durante os meses do inverno.
Os sintomas mais comuns são (39):
Os rinovírus são transmitidos de pessoa para pessoa via contato direto por grandes partículas no ar. A infecção por HRV inicia-se por inoculação intranasal e conjuntival, mas não por via oral. Estudos científicos demonstraram que o vírus é regularmente depositado nas mãos e introduzido no meio ambiente, uma vez que foi detectado em 40% das mãos de voluntários infectados naturalmente e 6% de objetos em casa (40).
Os enterovírus respiratórios (EVs), assim como os rinovírus (RVs), pequenos vírus de RNA, são as principais causas de infecções do trato respiratório superior e estão entre os agentes infecciosos mais frequentes em humanos em todo o mundo (41).
Ambos são pertencentes a família Picornaviridae e foram classificados em sete espécies distintas, sendo três espécies de rinovírus (RV-A a RV-C) e quatro espécies de enterovírus (EV-A a EV-D).
Apesar de serem da mesma família, as características desses vírus são distintas; o tropismo (capacidade de um vírus infectar especificamente determinadas células de um organismo) dos RVs é restrito às vias respiratórias superiores, exceto em alguns casos raros, enquanto os EVs podem infectar uma ampla gama de células diferentes e causar condições clínicas muito diversas (42,43).
As doenças decorrentes de EVs variam de:
Enquanto outros tipos de enterovírus são encontrados apenas no trato respiratório e causam sintomas semelhantes aos do rinovírus, principalmente EVs das espécies C e D, sendo, consequentemente, denominados enterovírus respiratórios.
A transmissão do vírus ocorre principalmente por contato direto ou por meio de um objeto contaminado (fômites), normalmente com inoculação no olho ou nariz pela ponta do dedo. Esses vírus são capazes de sobreviver nas mãos por várias horas, o que permite uma fácil transmissão de pessoa para pessoa na ausência de higiene adequada das mãos, principalmente na presença de altas cargas virais (44).
O bocavírus humano (HBoV) é um parvovírus, isolado há cerca de uma década, encontrado em amostras respiratórias, principalmente em crianças de 6 a 24 meses de idade com infecção respiratória aguda, e em amostras de fezes de pacientes com gastroenterite (45). Desde então, três subtipos adicionais de HBoV (HBoV1) foram identificados em amostras de fezes e nomeados como HBoV2, HBoV3 e HBoV4. O vírus foi detectado em outras amostras biológicas, como sangue, saliva e urina, bem como em amostras de água de rio e esgoto (46).
O HBoV acomete principalmente crianças de 6 a 24 meses com sintomas respiratórios como:
O HBoV2, assim como os outros subtipos, é encontrado mais frequentemente em amostras de fezes e está associado à gastroenterite, assim como possivelmente o HBoV3. Estudos mais recentes mostram que o HBoV pode ser detectado especificamente em tecidos como duodeno, mucosa dos seios paranasais e biópsias intestinais (47,48).
O bocavírus entra no organismo pelo trato respiratório e pela corrente sanguínea ou por ingestão direta, atingindo o trato gastrointestinal. Os casos de infecção por HBoV mostram uma alta taxa de coinfecções com outros patógenos respiratórios e gastroenterites como rinovírus humano, adenovírus, norovírus e rotavírus (49).
Os coronavírus são uma família de vírus de RNA envelopado, classificados na ordem dos Nidovirales. Esta família de coronavírus consiste em patógenos de várias espécies animais e de humanos, incluindo a síndrome respiratória aguda grave (SARS-CoV) e o novo coronavírus (SARS-CoV-2) (50).
Os coronavírus humanos eram conhecidos apenas por causarem o resfriado comum até que, em 2003, o coronavírus SARS-CoV foi responsável pela síndrome respiratória aguda grave (SARS).
Os coronavírus causam doenças respiratórias agudas e crônicas, entéricas e do sistema nervoso central (SNC) em animais e humanos (51). Os tipos mais comuns que infectam humanos são:
A infecção por SARS exibe um amplo quadro clínico, caracterizado principalmente por febre, dispneia, linfopenia e infecção do trato respiratório inferior (55). Sintomas gastrointestinais e diarreia também são comuns. Os indivíduos infectados apresentam contagens de plaquetas ligeiramente diminuídas, perfis de coagulação prolongados e enzimas hepáticas séricas ligeiramente elevadas. Sugere-se que gotículas transportadas pelo ar de pacientes infectados podem ser a principal via de transmissão.
A descoberta da enzima ACE2 nas células humanas como um receptor para o SARS-CoV (187) demonstrou como o SARS-CoV entra nas células hospedeiras e tem permitido a elucidação, a nível molecular, da transmissão cruzada do SARS-CoV (56).
Saiba mais sobre o SARS-CoV-2 em nosso artigo.
A prevenção dos vírus respiratórios está diretamente associada aos cuidados básicos de higiene, como:
Evitar aglomerações em locais fechados e manter distância das pessoas que apresentam sinais da doença são medidas importantes para controlar a disseminação dos vírus.
O diagnóstico das infecções respiratórias geralmente costuma ser clínico, baseado na manifestação de sintomas de resfriado comum, bronquiolite, crupe ou pneumonia, por exemplo, e pela epidemiologia local.
No entanto, os avanços em métodos moleculares têm facilitado a detecção e caracterização de grupos e cepas dos diversos vírus respiratórios, e são necessários principalmente quando a especificação do patógeno modifica o tratamento clínico e para identificar e determinar a causa de um surto.
A Synlab oferece um painel molecular de vírus respiratórios de DNA e RNA responsáveis por doenças respiratórias, que compreende a detecção dos vírus: Influenza A (H1, H3, H1pdm09), Influenza B, Vírus Sincicial Respiratório (A/B), Metapneumovírus, Adenovírus (AdV A/B/C/D/E/F), Coronavírus /CoV 229E/NL63/OC43), Enterovírus, Rhinovírus (HRV A/B/C), Bocavírus (HBoV 1/2/3/4), Vírus da Parainfluenza (PIV 1/2/3/4) em amostras do trato respiratório superior (exsudato nasofaríngeo /orofaríngeo) e amostras do trato respiratório inferior (LBA, escarro e/ou BAS) obtidas por swab ou raspagem do sitio afetado.
A detecção é realizada mediante reação em cadeia de polimerase em tempo real (qPCR).
A realização de exames precisos e atualizados é essencial para o diagnóstico mais assertivo e para o melhor direcionamento dos tratamentos. E a SYNLAB está aqui para te ajudar.
Oferecemos soluções diagnósticas com rigoroso controle de qualidade às empresas, pacientes e médicos que atendemos. Estamos no Brasil há mais de 10 anos, atuamos em 36 países e três continentes, e somos líderes na prestação de serviços na Europa.
Entre em contato com a equipe SYNLAB e conheça os exames disponíveis.
1. Jain S, Self WH, Wunderink RG, et al. Community-Acquired Pneumonia Requiring Hospitalization among U.S. Adults. N Engl J Med. 2015;373(5):415-427.
2. Schuster JE, Williams JV. Emerging Respiratory Viruses in Children. Infect Dis Clin North Am. 2018;32(1):65-74.
3. GBD 2015 Mortality and Causes of Death Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015 [published correction appears in Lancet. 2017 Jan 7;389(10064):e1
4. Burney PG, Patel J, Newson R, Minelli C, Naghavi M. Global and regional trends in COPD mortality, 1990-2010. Eur Respir J. 2015;45(5):1239-1247.
5. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65(2):87-108.
6. World Health Organization. Global tuberculosis report 2020. Geneva: World Health Organization; 2020.
7. The Global Asthma Report 2018. Auckland, New Zealand: Global Asthma Network, 2018
8. World Health Organization. Influenza (Seasonal). October 2023.
9. Cheng VC, To KK, Tse H, Hung IF, Yuen KY. Two years after pandemic influenza A/2009/H1N1: what have we learned?. Clin Microbiol Rev. 2012;25(2):223-263.
10. To KK, Chan JF, Chen H, Li L, Yuen KY. The emergence of influenza A H7N9 in human beings 16 years after influenza A H5N1: a tale of two cities. Lancet Infect Dis. 2013;13(9):809-821.
11. Chan JF, Lau SK, To KK, Cheng VC, Woo PC, Yuen KY. Middle East respiratory syndrome coronavirus: another zoonotic betacoronavirus causing SARS-like disease. Clin Microbiol Rev. 2015;28(2):465-522.
12. World Health Organization. 14.9 million excess deaths associated with the COVID-19 pandemic in 2020 and 2021 [Internet]. 5 May 2022.
13. DOLIN R. Common viral respiratory infections and severe acute respiratory syndrome (SARS). In: FAUCI, A.S. et al.. Harrison’s Principles of Internal Medicine. 17 ed.. Philadelphia: MacGraw-Hill, 2007.
14. Gaitonde DY, Moore FC, Morgan MK. Influenza: Diagnosis and Treatment. Am Fam Physician. 2019;100(12):751-758.
15. Centers for Disease Control and Prevention. Clinical Signs and Symptoms of Influenza. 2022
16. Dawood FS, Iuliano AD, Reed C, et al. Estimated global mortality associated with the first 12 months of 2009 pandemic influenza A H1N1 virus circulation: a modelling study [published correction appears in Lancet Infect Dis. 2012 Sep;12(9):655]. Lancet Infect Dis. 2012;12(9):687-695.
17. Duwell MM, Blythe D, Radebaugh MW, et al. Influenza A(H3N2) Variant Virus Outbreak at Three Fairs – Maryland, 2017. MMWR Morb Mortal Wkly Rep. 2018;67(42):1169-1173. Published 2018 Oct 26.
18. Henrickson KJ. Parainfluenza viruses. Clin Microbiol Rev. 2003;16(2):242-264. doi:10.1128/CMR.16.2.242-264.2003
19. Hutchinson AF, Ghimire AK, Thompson MA, et al. A community-based, time-matched, case-control study of respiratory viruses and exacerbations of COPD. Respir Med. 2007;101(12):2472-2481.
20. Peck AJ, Englund JA, Kuypers J, et al. Respiratory virus infection among hematopoietic cell transplant recipients: evidence for asymptomatic parainfluenza virus infection. Blood. 2007;110(5):1681-1688.
21. Lozano R, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. The Lancet. 2012; Volume 380: 2095-2128.
22. Instituto Fernandes Figueira – Fiocruz. Prevenção de infecção pelo vírus sincicial respiratório (VSR) em unidades neonatais e na comunidade. 2019
23. Rezaee F, Linfield DT, Harford TJ, Piedimonte G. Ongoing developments in RSV prophylaxis: a clinician’s analysis. Curr Opin Virol. 2017;24:70-78.
24. Bloom-Feshbach K, Alonso WJ, Charu V, Tamerius J, Simonsen L, et al. (2013) Latitudinal Variations in Seasonal Activity of Influenza and Respiratory Syncytial Virus (RSV): A Global Comparative Review. PLOS ONE 8(2): e54445.
25. Houben ML, Bont L, Wilbrink B, et al. Clinical prediction rule for RSV bronchiolitis in healthy newborns: prognostic birth cohort study. Pediatrics. 2011;127(1):35-41.
26. American Academy of Pediatrics Committee on Infectious Diseases; American Academy of Pediatrics Bronchiolitis Guidelines Committee. Updated guidance for palivizumab prophylaxis among infants and young children at increased risk of hospitalization for respiratory syncytial virus infection. Pediatrics. 2014;134(2):e620-e638.
27. van den Hoogen BG, de Jong JC, Groen J, et al. A newly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med. 2001;7(6):719-724.
28. Stockton J, Stephenson I, Fleming D, Zambon M. Human metapneumovirus as a cause of community-acquired respiratory illness. Emerg Infect Dis. 2002;8(9):897-901.
29. Pelletier G, Déry P, Abed Y, Boivin G. Respiratory tract reinfections by the new human Metapneumovirus in an immunocompromised child. Emerg Infect Dis. 2002;8(9):976-978.
30. Ebihara T, Endo R, Kikuta H, Ishiguro N, Ishiko H, Hara M, Takahashi Y, Kobayashi K. Human metapneumovirus infection in Japanese children. J Clin Microbiol. 2004 Jan;42(1):126-32.
31. Ebihara T, Endo R, Kikuta H, et al. Human metapneumovirus infection in Japanese children. J Clin Microbiol. 2004;42(1):126-132.
32. Schuster JE, Williams JV. Human Metapneumovirus. Microbiol Spectr. 2014;2(5):10.1128/microbiolspec.AID-0020-2014.
33. Lynch JP 3rd, Kajon AE. Adenovirus: Epidemiology, Global Spread of Novel Serotypes, and Advances in Treatment and Prevention. Semin Respir Crit Care Med. 2016;37(4):586-602.
34. Erdman DD, Xu W, Gerber SI, et al. Molecular epidemiology of adenovirus type 7 in the United States, 1966-2000. Emerg Infect Dis. 2002;8(3):269-277.
35. Chang SY, Lee CN, Lin PH, et al. A community-derived outbreak of adenovirus type 3 in children in Taiwan between 2004 and 2005. J Med Virol. 2008;80(1):102-112.
36. Kim YJ, Boeckh M, Englund JA. Community respiratory virus infections in immunocompromised patients: hematopoietic stem cell and solid organ transplant recipients, and individuals with human immunodeficiency virus infection. Semin Respir Crit Care Med. 2007;28(2):222-242.
37. Ison MG. Adenovirus infections in transplant recipients. Clin Infect Dis. 2006;43(3):331-339.
38. Bertino JS. Cost burden of viral respiratory infections: issues for formulary decision makers. Am J Med. 2002;112 Suppl 6A:42S-49S.
39. Pappas DE, Hendley JO, Hayden FG, Winther B. Symptom profile of common colds in school-aged children. Pediatr Infect Dis J. 2008;27(1):8-11.
40. Gwaltney JM Jr, Moskalski PB, Hendley JO. Hand-to-hand transmission of rhinovirus colds. Ann Intern Med. 1978;88(4):463-467.
41. Royston L, Tapparel C. Rhinoviruses and Respiratory Enteroviruses: Not as Simple as ABC. Viruses. 2016 Jan 11;8(1):16.
42. Tapparel C, Siegrist F, Petty TJ, Kaiser L. Picornavirus and enterovirus diversity with associated human diseases. Infect Genet Evol. 2013;14:282-293.
43. Romero JR, Newland JG. Viral meningitis and encephalitis: traditional and emerging viral agents. Semin Pediatr Infect Dis. 2003;14(2):72-82.
44. L’Huillier AG, Tapparel C, Turin L, Boquete-Suter P, Thomas Y, Kaiser L. Survival of rhinoviruses on human fingers. Clin Microbiol Infect. 2015;21(4):381-385.
45. Allander T, Tammi MT, Eriksson M, Bjerkner A, Tiveljung-Lindell A, Andersson B. Cloning of a human parvovirus by molecular screening of respiratory tract samples [published correction appears in Proc Natl Acad Sci U S A. 2005 Oct 25;102(43):15712]. Proc Natl Acad Sci U S A. 2005;102(36):12891-12896.
46. Kapoor A, Slikas E, Simmonds P, et al. A newly identified bocavirus species in human stool. J Infect Dis. 2009;199(2):196-200.
47. Jartti T, Hedman K, Jartti L, Ruuskanen O, Allander T, Söderlund-Venermo M. Human bocavirus-the first 5 years. Rev Med Virol. 2012;22(1):46-64.
48. Santos N, Peret TC, Humphrey CD, et al. Human bocavirus species 2 and 3 in Brazil. J Clin Virol. 2010;48(2):127-130.
49. Schildgen O. Human bocavirus: lessons learned to date. Pathogens. 2013;2(1):1-12. Published 2013 Jan 11.
50. Weiss SR, Navas-Martin S. Coronavirus pathogenesis and the emerging pathogen severe acute respiratory syndrome coronavirus. Microbiol Mol Biol Rev. 2005 Dec;69(4):635-64.
51. McIntosh, K. (1974). Coronaviruses: A Comparative Review. In: Arber, W., et al. Current Topics in Microbiology and Immunology / Ergebnisse der Mikrobiologie und Immunitätsforschung. Current Topics in Microbiology and Immunology / Ergebnisse der Mikrobiologie und Immunitätsforschung, vol 63. Springer, Berlin, Heidelberg.
52. Ebihara T, Endo R, Ma X, Ishiguro N, Kikuta H. Detection of human coronavirus NL63 in young children with bronchiolitis. J Med Virol. 2005;75(3):463-465.
53. Woo PC, Lau SK, Chu CM, et al. Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia. J Virol. 2005;79(2):884-895.
54. Ksiazek TG, Erdman D, Goldsmith CS, et al. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med. 2003;348(20):1953-1966.
55. Tsui PT, Kwok ML, Yuen H, Lai ST. Severe acute respiratory syndrome: clinical outcome and prognostic correlates. Emerg Infect Dis. 2003;9(9):1064-1069.
56. Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003;426(6965):450-454.
57. Chan JFW, et al. The emerging novel Middle East respiratory syndrome coronavirus: The “knowns” and “unknowns”. Journal of the Formosan Medical Association. 2013; Volume 112: 372-381.
58. Al-Tawfiq JA, Hinedi K, Ghandour J, et al. Middle East respiratory syndrome coronavirus: a case-control study of hospitalized patients. Clin Infect Dis. 2014;59(2):160-165.
A serotonina, conhecida popularmente como o “hormônio da felicidade”, é…
Continuar lendo
Você já sentiu desconforto após comer certos alimentos, como inchaço,…
Continuar lendo
A dermatomiosite é uma doença inflamatória rara que afeta a…
Continuar lendo